Las esperanzas eran altas, pero la decepción fue aún mayor: cuando en 2019 se suspendieron dos estudios que probaban un medicamento contra el Alzheimer por no tener perspectivas de éxito, la frustración entre los expertos fue palpable: “Un desastre para todo el campo”, se quejó uno. Otro experto habló de “una enorme decepción para la neurociencia”.
Cuatro años después, vuelve a reinar una sensación de optimismo: por un lado,… Anticuerpos aducanumab, cuyas pruebas se suspendieron entonces por falta de posibilidades de éxito, fue aprobado en EE.UU. para su tratamiento contra la enfermedad de Alzheimer, en una decisión muy controvertida. El segundo llegó en los Estados Unidos de América a principios de 2023. Anticuerpos contra lecanimab Al mercado –cuya aprobación se está estudiando actualmente en la Unión Europea–.
Recientemente lo publicó la revista especializada “JAMA”. Resultados de un estudio de un tercer anticuerpo, donanemab, que está pendiente de aprobación en EE.UU. Los anticuerpos tienen como objetivo descomponer ciertos depósitos en el cerebro.
Los anticuerpos “no son curas milagrosas”
Los medios de comunicación juzgan este acontecimiento como un “gran avance” y hablan de él como un “hito” y un “punto de inflexión”. El veredicto de muchos expertos es más aleccionador: “Por ahora, los beneficios de los anticuerpos todavía son manejables”, dice Richard Dodell de la Universidad de Duisburg-Essen, experto en Alzheimer de la Sociedad Alemana de Neurología (DGN). Ozgur Onur, del Hospital Universitario de Colonia, también limita el éxtasis: “Estas no son curas milagrosas”. Sin embargo, el neurólogo añade: “Pero algo está sucediendo: por primera vez tenemos estudios que demuestran los efectos”.
“Hemos aprendido mucho”, afirma Johannes Levin, del Centro Alemán de Enfermedades Neurodegenerativas (DZNE) y de la Universidad Ludwig Maximilian de Múnich (LMU), “ahora tenemos una muy buena idea de dónde podría ser útil empezar terapéuticamente”.
La larga búsqueda de la razón
La necesidad es enorme: la enfermedad de Alzheimer es la forma más común de demencia en todo el mundo. Sólo en Alemania se estima que alrededor de un millón de personas están infectadas con la enfermedad, y el número aumenta debido al crecimiento demográfico. Los investigadores llevan décadas buscando la causa de la enfermedad. Pero hay una circunstancia que dificulta especialmente la investigación: el daño cerebral inicialmente pasa desapercibido durante muchos años; Cuando se diagnostica, la demencia ya ha alcanzado un estado avanzado. “Después de eso, la gente en promedio no vive otros 10 años”, dice Levin.
En el momento del diagnóstico, el cerebro de los pacientes con Alzheimer contiene depósitos notables de dos proteínas: entre las neuronas La beta amiloide (Abeta) se acumula para formar las llamadas placas.. Abeta forma parte de una proteína muy extendida en el reino animal y cuya función se desconoce actualmente. Además, la proteína tau se acumula en las células nerviosas para formar las llamadas fibrillas.
Durante muchos años, la mayor parte de la comunidad investigadora se dividió en dos bandos, sospechando que una de las dos proteínas (Abeta o tau) era la causa de los síntomas. Ahora está surgiendo un mecanismo de enfermedad en el que ambos depósitos están significativamente involucrados. “Abeta y Tao van juntos”, dice Levin.
Será posible estabilizar la enfermedad de Alzheimer hasta el punto en que las personas no pierdan su independencia.
Juan LevinCentro Alemán de Enfermedades Neurodegenerativas (DZNE)
La evidencia de esto la han proporcionado al menos estudios de los tres anticuerpos: cuyo objetivo es eliminar distintos depósitos de Abeta entre las neuronas. Los ingredientes activos lo hacen de forma muy eficaz, especialmente donanemab. En el estudio de 18 meses, el anticuerpo eliminó las placas en una gran proporción de los 860 participantes hasta el punto en que Abeta ya no era detectable. “Un descubrimiento sorprendente”, afirma Onur, el experto en Colonia.
Pero lo más importante es que el efecto sobre la enfermedad en sí se mantuvo bajo control, con una progresión ralentizada hasta un 35% en comparación con el placebo, según el subgrupo. En otras palabras, la demencia siguió progresando, pero no tan rápidamente. Dodel, experto de la DGN, duda que los afectados puedan notar el efecto.
Mucho esfuerzo y graves efectos secundarios.
El tratamiento tiene además dos desventajas adicionales: gran esfuerzo. El ingrediente activo se administra por vía intravenosa cada cuatro semanas, durante dos horas cada vez. Sobre todo, los efectos secundarios son potencialmente graves, escribió en JAMA el equipo de estudio dirigido por John Sims de la farmacéutica Eli Lilly and Company.
Casi uno de cada cuatro participantes (24%) experimentó hinchazón y edema en el cerebro, y tres pacientes murieron como resultado. Por lo tanto, el tratamiento debe controlarse, por ejemplo mediante exámenes periódicos de resonancia magnética (MRI). “En última instancia, se necesitarán más datos para determinar si los riesgos de estos medicamentos superan sus modestos beneficios clínicos”. El comentario de JAMA sobre el estudio dice.
1
Millones Se estima que en Alemania hay personas que padecen la enfermedad de Alzheimer.
Levin cree que la razón por la que el tratamiento no frena significativamente la progresión de la enfermedad a pesar del éxito de la eliminación de Abeta se debe a la proteína tau. Una forma de esto se acumula en las células nerviosas y, según muchos expertos, es la verdadera causa de la muerte celular.
“Ahora conocemos muy bien la secuencia de los acontecimientos”, afirma Levin. “Sabemos que los procesos patológicos que conducen a la enfermedad de Alzheimer comienzan unos 20 años antes de que aparezcan los primeros síntomas”.
Primero vienen las placas, luego las fibrillas.
En consecuencia, el proceso comienza inicialmente con la formación de placas Abeta en el cerebro. Aunque estos depósitos no parecen dañar las neuronas directamente, conducen a la formación de fibrillas tau en las células -a través de un proceso aún no completamente comprendido- que puede ser la causa real de la neurodegeneración. Esto se ve respaldado por el hecho de que la zona del cerebro afectada por las fibrillas tau en los pacientes con Alzheimer corresponde exactamente a la zona cuya función está restringida, explica Levin. Además, el anticuerpo donanemab ayuda mejor a las personas que todavía tienen algunas fibrillas tau en sus células nerviosas.
Las células muertas no pueden renovarse
Para el tratamiento, esto significa: incluso si se eliminan los depósitos de Abeta del cerebro, la cadena tau puede tener vida propia. Entonces será demasiado tarde para detener la muerte celular una vez que se elimine Abeta. Si este modelo es correcto, entonces también se deben eliminar las fibras tau. Sin embargo, a diferencia de las placas, estas proteínas no se encuentran fuera de las neuronas, sino dentro de ellas. “Es difícil lidiar con el Tao”, dice Dowdell.
Dado que las células muertas del cerebro no se renuevan, la enfermedad de Alzheimer no se puede revertir. Pero es de esperar que algún día –tal vez no muy lejano– el progreso se detenga.
La demencia debería reconocerse mucho antes
Los expertos coinciden en que la clave para lograrlo es la terapia combinada: debe eliminar los depósitos de Abeta y tau en el cerebro. Además, el tratamiento debe prevenir los procesos inflamatorios en el cerebro asociados con la enfermedad, así como los cambios en los vasos sanguíneos.
Esta terapia combinada tendría más sentido si se iniciara muy pronto, si es posible antes de que se produzca el primer daño. Pero para ello habrá que reconocer la aparición de la demencia mucho antes de que aparezcan los primeros síntomas.
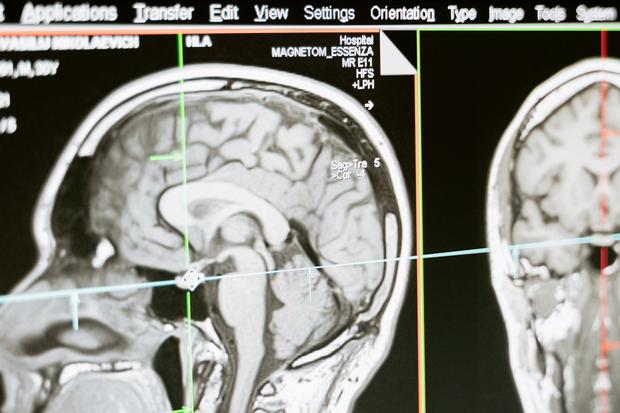
Es útil hacerse un análisis de sangre confiable en el que se extrae sangre y luego se analiza en un laboratorio. Esto es exactamente lo que pretende hacer el conjunto actual de investigaciones sobre la enfermedad de Alzheimer. Además de las pruebas de memoria, el diagnóstico de la enfermedad se basa actualmente en análisis del líquido cefalorraquídeo (LCR) y tomografías por emisión de positrones (PET) para detectar Abeta y tau. Esto es complejo, costoso y muy estresante para los pacientes. Un buen análisis de sangre debería ayudar a identificar tempranamente a las personas que podrían beneficiarse de un tratamiento preventivo.
Aún está pendiente un análisis de sangre fiable
Aunque muchas de estas pruebas se están probando, todavía falta un biomarcador fiable, es decir, un parámetro que pueda medirse en la sangre para diagnosticar la enfermedad de Alzheimer. Hace ya dos años que el llamado Prueba de precisión de la sangre Aprobado para EE.UU. y la Unión Europea. Su objetivo es mostrar a los pacientes con los primeros síntomas si se trata de la enfermedad de Alzheimer. La prueba determina principalmente la relación entre las variables Abeta 42 y 40.
En la revista “PNAS” A finales de 2022, un equipo dirigido por Valerie Daggett de la Universidad de Washington en Seattle también presentó una prueba que no sólo podría identificar a los pacientes con Alzheimer, sino que también debería comenzar años antes de que aparezcan los primeros síntomas. Sin embargo, sólo se probó como prueba de concepto en poco menos de 380 muestras de sangre y no en la práctica clínica.
¿Qué podría pasar con el sistema de salud?
Otras pruebas se centran Sobre ciertas formas de proteína tau. “Hay muchas publicaciones que sugieren que los análisis de sangre son cada vez más fiables”, dice Dowdell. Ozgur Onur añade que los procedimientos de prueba individuales ya han logrado buenos resultados, pero aún son demasiado inexactos para ser utilizados en la práctica. Sin embargo, no está claro qué significaría para el sistema sanitario una prueba temprana eficaz: Richard Dowdell supone que si se aprueba lecanimab en la UE, el precio se situará entre 20.000 y 30.000 euros al año, con una posibilidad de entre 150.000 y 150.000 euros. por año A 200 mil euros. Personas calificadas.
Además, los afectados deben ser examinados de cerca debido a los frecuentes efectos secundarios. “Los costes ejercerán una presión significativa sobre el sistema sanitario alemán”, afirma Dodel.
La esperanza: el Alzheimer se convertirá en una enfermedad crónica
El experto de Munich Johannes Levin cree que a largo plazo la enfermedad de Alzheimer se convertirá en una enfermedad crónica, similar a la diabetes 2. “Será posible estabilizar la enfermedad hasta el punto en que las personas no pierdan su independencia”, considera el médico. ¿Quién es? Involucrado en una empresa que busca ingredientes activos.
Sin embargo, esto puede llevar algún tiempo: incluso si se encuentra un ingrediente activo eficaz, según el investigador, probablemente pasarán varios años antes de que esté en el mercado. “Estamos en el camino correcto”, dice Levin.




More Stories
Braunschweiger tiene un huésped molesto e incluso peligroso
El PIB aumenta repentinamente un 0,2%
Estos son los cinco mayores factores de riesgo